Dieta Cetogénica y sus beneficios contra el Cáncer
La dieta cetogénica, una dieta alta en grasas y baja en carbohidratos con cantidades adecuadas de proteínas, parece sensibilizar a la mayoría de los cánceres al tratamiento convencional al explotar el metabolismo reprogramado de las células cancerosas, lo que hace que la dieta cetogénica sea un candidato prometedor como terapia complementaria contra el cáncer.
El cáncer es uno de los mayores desafíos de salud pública en todo el mundo, y aún carecemos de estrategias complementarias para mejorar de manera significativa los tratamientos convencionales, como la quimio o la radioterapia.
El uso de la dieta cetogénica o su combinación con otras estrategias nutricionales como el ayuno intermitente pueden tener numerosos beneficios para nuestra salud.
¿Qué es la dieta cetogénica?
La dieta cetogénica se basa en una alta proporción de grasas, una proporción moderada o baja de proteínas y una cantidad muy pequeña de carbohidratos. Con este tipo de dieta se pretende estimular al cuerpo para producir energía usando como combustible las grasas en lugar de la glucosa (hidratos de carbono).

Pero, ¿cómo se produce el cambio de fuente energética? Expliquémoslo por partes.
Principios Bioquímicos
Todos los seres vivos necesitan energía. La moneda energética universal es la molécula de ATP (adenosín trifosfato) que se sintetiza dentro de las mitocondrias, las centrales energéticas de nuestras células. En presencia de oxígeno, la producción de este ATP se lleva a cabo principalmente a través de un proceso llamado fosforilación oxidativa. Esta reacción se produce gracias a una cadena de transporte de electrones que van pasando de unos complejos proteicos a otros, localizados a lo largo de la membrana mitocondrial [1].
Principales fuentes de energía
La fosforilación oxidativa puede utilizar tres tipos de combustibles procedentes de los tres macronutrientes de nuestra dieta: aminoácidos (proteínas), glucosa (hidratos de carbono) y ácidos grasos (grasas). Cada uno de estos combustibles va a sufrir una degradación a través unas reacciones catabólicas que finalizarán en la obtención de una molécula común: la acetil-coencima A (acetil-CoA). Esta molécula entrará en una reacción cíclica llamada Ciclo de Krebs o Ciclo de los ácidos tricarboxílicos. Las moléculas resultantes de estas reacciones (NADPH+ y FADPH+) cederán sus protones a la cadena de transporte electrónico de la mitocondria permitiendo finalmente la producción de ATP (la moneda energética) mediante la fosforilación oxidativa en la mitocondria. Esto también es conocido como la respiración mitocondrial.
Como se ha dicho anteriormente, para la obtención del acetil-CoA, que ingresará en el ciclo de Krebs, hay tres posibles combustibles.
Por un lado, el uso de aminoácidos como fuente de energía implica la degradación de la proteína que forma nuestros músculos. Esto llevaría a una pérdida de musculatura, por lo que solo en casos extremos el cuerpo recurrirá a ellos.
Por otro lado, ¿de qué depende que el cuerpo use glucosa o ácidos grasos? De la cantidad de glucosa que tengamos en sangre.
Glucosa como principal fuente de energía
Tras una comida, los niveles de glucosa en sangre aumentan activando a su vez la segregación de insulina. La insulina es la hormona que indica a las células que deben incorporar glucosa en su interior. Cuando esto pasa se activan los mecanismos de degradación de la glucosa. Las reacciones de degradación de la glucosa es lo que se conoce como glucólisis. La molécula final que se obtiene de la glucolisis es el piruvato, que atravesará la membrana mitocondrial donde será transformado en acetil-CoA. De este modo comenzará el ciclo de Krebs que acabará finalmente en la producción de ATP mediante la fosforilación oxidativa.
La glucosa que no se gaste en el momento se va a almacenar en forma de glucógeno en el hígado y sobre todo en el músculo esquelético. A medida que las células van consumiendo la glucosa disponible en la sangre, los niveles de insulina disminuyen. Es entonces cuando actúa su hormona antagonista, el glucagón. El glucagón indicará al hígado y al músculo que la glucosa se está agotando y que por lo tanto es necesario que sinteticen más glucosa a partir del glucógeno almacenado. Esto es lo que se conoce como gluconeogénesis. De esta forma las células dispondrán de más glucosa de las que obtener más energía.
Es importante señalar que el cerebro necesita un aporte continuo de glucosa, por lo que las reservas de glucógeno del hígado se destinan casi de manera exclusiva para él.
Ácidos grasos como fuente alternativa
Las reservas de glucógeno no son infinitas y a medida que pasan las horas tras la ingesta calórica, se van gasta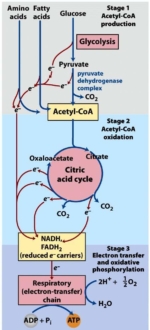 ndo. En casos de ayuno o ejercicio prolongado, estas reservas se agotarán. Es entonces cuando empiezan a movilizarse las grasas almacenadas en los adipocitos en forma de triglicéridos, estos son los universalmente conocidos como los “michelines”.
ndo. En casos de ayuno o ejercicio prolongado, estas reservas se agotarán. Es entonces cuando empiezan a movilizarse las grasas almacenadas en los adipocitos en forma de triglicéridos, estos son los universalmente conocidos como los “michelines”.
Movilización de las grasas
Los triglicéridos se van a descomponer en una molécula de glicerol y en una cadena de ácidos grasos. Ambas moléculas son liberadas por los adipocitos al torrente sanguíneo y serán incorporadas por el resto de células de nuestro cuerpo.
En su intento de conseguir glucosa a toda costa, la célula llevará a cabo un proceso de gluconeogénesis (síntesis de glucosa) a partir de la molécula de glicerol. Pero el rendimiento energético de este proceso no es suficiente. Por ello, será necesario empezar a usar otra fuente alternativa de combustible.
Degradación de los ácidos grasos
De esta forma, en ausencia total de glucosa, el cuerpo recurrirá a la degradación de los ácidos grasos para la producción del ATP. Este proceso se conoce como β-oxidación de los ácidos grasos. Durante esta reacción, las cadenas de carbonos de los ácidos grasos se irán descomponiendo cíclicamente obteniendo moléculas de acetil-CoA que entrarán como siempre en el ciclo de Krebs finalizando con la producción de ATP mediante la fosforilación oxidativa. El rendimiento energético obtenido ya si es suficiente para el correcto funcionamiento de la célula.

Cetogénesis como adaptación metabólica
Durante la prehistoria, el hombre primitivo sufría periodos de escasez de alimentos y hambruna. Había periodos del año en los que debido al clima solo podía alimentarse de lo que cazaba. La adaptación a los recursos nutricionales limitados de su entorno requería el desarrollo de mecanismos que permitiesen el funcionamiento temporal en un estado de deficiencia energética, tanto a nivel sistémico como celular.
Además, como ya se mencionó anteriormente, el cerebro necesita un aporte continuo de glucosa. Aquí presentaba un inconveniente, ya que el cerebro es el único órgano que no puede llevar a cabo la β-oxidación de los ácidos grasos. La razón es que los ácidos grasos no pueden atravesar la barrera hematoencefálica. Por ello, necesita un combustible alternativo a la glucosa de fácil acceso. Aquí es donde intervienen los cuerpos cetónicos.
Cetogénesis
Volvamos un poco atrás, ¿recuerdas el atil-CoA resultante de la β-oxidación de los ácidos grasos? Pues bien, este, al entrar en el ciclo de Krebs se une a la molécula llamada oxalacetato para formar otra distinta, el citrato. En periodos prolongados sin aporte calórico, se observa un alto grado de oxidación de ácidos grasos en el hígado. Esto hace que la entrada al ciclo de Krebs se sature por la gran cantidad de acetil-CoA producida. Este exceso de acetil-CoA se desvía a la producción de cuerpos cetónicos, proceso llamado cetogénesis.
Aunque en menor medida, la cetogénesis también es llevada a cabo en otros tejidos como en los renales, y células como los astrocitos y los enterocitos.[2] Hay tres tipos de cuerpos cetónicos: acetoacetato, β-hidroxibutirato y acetato. Estas moléculas son liberadas a la sangre para ser incorporadas por el resto de células del organismo para ser usadas como combustible para la producción de ATP.
De esta forma, el resto de tejidos cambian su metabolismo tanto a la oxidación de los ácidos grasos como a la degradación de los cuerpos cetónicos (cetolisis). A diferencia de la cetogénesis, la cetolisis puede llevarse a cabo en casi todas las células de nuestro cuerpo. La única excepción se da en aquellas células que por alguna razón tengan el metabolismo mitocondrial alterado. ¡Ojo a este dato!, ya que será importante para más adelante.
Cetolisis
La degradación de los cuerpos cetónicos o cetolisis es el proceso contrario a la cetogénesis. Por medio de la cetolisis se generarán de nuevo moléculas de acetil-CoA que podrán ingresar en el ya conocido ciclo de Krebs. La cetolisis es la reacción metabólica más eficiente en la producción de energía, incluso más que la glucolisis. Si el estado de cetosis (presencia de cuerpos cetónicos en el cuerpo) se prolonga en el tiempo, la cetolisis se impondrá en todos los tejidos. De esta forma el organismo se irá haciendo cada vez más eficiente en metabolizar cuerpos cetónicos.
Además, los cuerpos cetónicos son capaces de atravesar la barrera hematoencefálica para llegar al cerebro, permitiendo así a las células neuronales producir energía a través de la cetolisis [3].


Dieta cetogénica como herramienta terapéutica
Desde tiempos inmemoriales, es conocido que el ayuno o la “dieta de agua” ayudaban a reducir las convulsiones que se producen durante los episodios epilépticos. [4]
En 1920, se descubrió que una dieta alta en grasas, como por ejemplo la “dieta cetogénica” que es baja en hidratos de carbono, podría reproducir el estado de ayuno en el organismo. Los efectos beneficiosos fueron atribuidos a la producción de cetonas en el hígado [5].
Epilepsia
A pesar de su éxito, con la llegada de los fármacos antiepilépticos en 1940, la dieta cetogénica dejó de usarse. Sin embargo, su uso clínico aumentó en los 90 siendo ahora una terapia bien establecida para aquellos tipos de epilepsias de difícil tratamiento, además de para una amplia variedad de desórdenes neuronales [6]. Por ejemplo, se está aplicando en enfermedades como el Parkinson, Alzheimer, Narcolepsia, migrañas, etc.
Desórdenes metabólicos
Se sabe que el uso terapéutico de esta dieta mejora la función mitocondrial de las células considerándose un buen tratamiento para los desórdenes metabólicos. Un ejemplo de esos desórdenes son: diabetes, obesidad o síndrome metabólico [7]. El estudio más conocido para el tratamiento de la obesidad fue el llevado a cabo por el Dr. Robert Atkins (Dr.Atkins Diet Revolution 1972).
Procesos procancerígenos
Se ha demostrado que en estado de cetosis, se producen una serie de metabolitos que van a desencadenar la activación de determinadas rutas de señalización con efectos antiinflamatorios [8].
Estos hechos están relacionados con las recientes evidencias de los efectos anticancerígenos que la dieta cetogénica podría tener. Y es que es sabido que la hiperinsulinemia, la hiperglucemia y los procesos de inflamación crónica son fenómenos que afectan a la progresión neoplástica, es decir, al desarrollo tumoral. Por ello, en los últimos años están surgiendo numerosos estudios preclínicos y clínicos que se centran en los posibles beneficios de la dieta cetogénica en el tratamiento del cáncer [9].
Dieta cetogénica como tratamiento frente al cáncer
Cada vez son más conocidas las diferencias que existen entre las células normales y las células tumorales. Entre estas diferencias encontramos la potenciación de la proliferación celular, inhibición de las rutas de apoptosis, inhibición de los mecanismos de reparación del ADN, etc. Cada una de estas diferencias puede usarse como diana hacia la que dirigir nuestra estrategia terapéutica.
Fenotipo metabólico tumoral como diana terapéutica
Entre estas diferencias encontramos una que es clave para la estrategia que abordamos en este artículo: las células normales tienen un metabolismo energético diferente a las células tumorales. Como ya se ha insinuado anteriormente, la mayoría de las células tumorales tienen el metabolismo mitocondrial alterado. Las diferencias son tan grandes con respecto a las células sanas que se habla de un fenotipo metabólico característico de las células tumorales. Este fenotipo metabólico les confiere una ventaja adaptativa que les permite no solo crecer sino también modificar su entorno [10].
El interés sobre el fenotipo metabólico de las células tumorales está creciendo en los últimos años. La razón se debe a que las recientes evidencias muestran cómo esta desregularización del metabolismo afecta a todos los hallmarks del cáncer, es decir, tiene un efecto directo sobre el resto de características que diferencian a una célula tumoral de una célula sana.

La dieta cetogénica podría representar una importante manipulación nutricional que podría usarse para explotar el fenotipo metabólico de las células tumorales. De esta forma, se mejorarían los resultados de las terapias convencionales mediante la mejora selectiva del estrés oxidativo de las células cancerígenas [11].
A diferencia del resto de terapias actuales que se centran solo en uno de los hallmarks, la dieta cetogénica tiene efecto sobre todos ellos pudiéndose convertir en una potente alternativa terapéutica frente al cáncer.
Bases del fenotipo metabólico tumoral
Se han descrito numerosas mutaciones tanto en el ADN mitocodrial como en el ADN nuclear que afectan a proteínas mitocondriales en multitud de tipos tumorales: cabeza, cuello, próstata, ovario, hígado, colon y mama. Estas mutaciones provocan alteraciones en la cadena de transporte mitocondrial producida durante la ya bien conocida fosforilación oxidativa. Debido a esto, se van a producir gran cantidad de moléculas reactivas (reactive oxygen species, ROS) que producirían daño en las células tumorales. Es lo que se conoce como estrés oxidativo. Este estrés oxidativo es muy grande en la célula tumoral.
Para compensar esta situación, la célula tumoral va a potenciar la glucolisis, hasta 30 veces por encima de la actividad normal, generando mucho piruvato (última molécula de la glucolisis). Por un lado, se va a producir una fermentación del piruvato a lactato para la obtención de ATP. Esta fermentación va a producirse incluso ante la presencia de oxígeno. Por otro lado, parte del piruvato va a entrar en otra vía, llamada la vía de las pentosas fosfato produciendo moléculas de NADPH+. Estos fenómenos se conocen como el efecto Warburg [12].
El efecto Warburg tiene un poder antioxidante (reductor). Gracias a él la célula tumoral consigue contrarrestar el estrés oxidativo, permitiendo un balance REDOX (de oxidación-reducción). De esta forma impiden la toxicidad de las moléculas ROS.

Mecanismo de acción de la dieta cetogénica
Para prevenir el proceso de carcinogénesis, o lo que es lo mismo, la ralentización del desarrollo tumoral, la dieta cetogénica actúa sobre los siguientes mecanismos:
Reducción de la glucosa y la insulina
La mayoría de las células tumorales tienen mitocondrias disfuncionales, por lo tanto, son incapaces de llevar a cabo la cetolisis y la oxidación de los ácidos grasos. Esto, junto con la no disponibilidad de glucosa (provocada por la dieta cetogénica) dará lugar a la incapacidad de las células tumorales para producir la energía necesaria para sobrevivir.
Por otro lado, el receptor de la insulina, localizado en la membrana de todas las células de nuestro cuerpo, juega un papel fundamental como activador de multitud de rutas que ayudan al desarrollo tumoral: proliferación celular (RAS y MAPK), supervivencia (PI3K, Akt y mTOR), activación de mecanismos pro-inflamatorios y anti-apoptóticos (NFκB) o diferenciación y malignización tumoral (β-catenin/Wnt).
En estudios con ratones se ha observado que en aquellos alimentados con dieta cetogénica hay una menor presencia de receptores de insulina. Además, la dieta cetogénica inhibe la producción de insulina en el páncreas limitando el consumo de glucosa.
Por otro lado, está ampliamente descrito cómo la dieta cetogénica sensibiliza al tejido sano a la presencia de insulina, disminuyendo su circulación en la sangre [14], de ahí a sus aplicaciones sobre la diabetes.
Modulación del estrés oxidativo
Como se ha explicado anteriormente, el fecto Warburg protege a la célula tumoral del daño oxidativo. La inhibición de este fenómeno desestabilizará el metabolismo tumoral.
A pesar de que la dieta cetogénica impide la glucolisis y el metabolismo de las pentosas fosfato (ambos actúan inclinando la balanza hacia el lado oxidante), hay estudios que han descubierto que los cuerpos cetónicos activan antioxidantes endógenos celulares [15], oponiéndose a lo anterior. Por otro lado, hay estudios que afirman que el metabolismo de las cetonas inducen la producción de moléculas ROS [16]. Estos datos podrían resultar contradictorios, por lo tanto, se necesitarían más estudios para entender mejor cómo los cuerpos cetónicos actúan sobre el balance REDOX.
Aunque por sí misma la dieta cetogénica no parece potenciar el daño por estrés oxidativo en las células tumorales, si parece aumentar su susceptibilidad a las terapias pro-oxidativas, como son la quimio y la radioterapia [17].
Por otro lado, en estudios preliminares se ha comprobado que la dieta cetogénica actúa como antioxidante en los tejidos sanos que rodean al tumor protegiéndolos del daño oxidativo que provocan la quimio y la radioterapia [18].
Reducción de la inflamación
Se sabe que la inflamación sistémica es un factor negativo para los pacientes con cáncer con independencia del tipo o del estadío tumoral. De hecho, las células inmunitarias que rodean los tumores están constantemente produciendo factores o moléculas (TNF-α, IL-6 e IL-1β) que mantienen este estado inflamatorio.
Estudios recientes han demostrado que la dieta cetogénica es capaz de reducir los marcadores inflamatorios en humanos. Además, los cuerpos cetónicos también inhiben de manera directa la producción de factores responsables de la inflamación [19]. Un ejemplo claro de ello es la molécula NLRP3, que tiene un papel principal en la activación de los procesos inflamatorios en el cerebro y responsable de la resistencia a radioterapia. Hay estudios que han demostrado cómo el β-hidroxibutirato (uno de los tres cuerpos cetónicos) inhibe la producción de NLRP3 en glioma (tumor cerebral) [20]. Por ello, podría pensarse que la dieta cetogénica podría ayudar a revertir los fenómenos de resistencia a radioterapia que aparecen a lo largo del desarrollo de ciertos tumores.
Potenciación de la actividad inmunitaria antitumoral
Recientemente se ha demostrado que la dieta cetogénica potencia la actividad del sistema inmunitario para luchar contra las células tumorales. En estado de cetosis, los linfocitos T (CD4+, CD8+ y Treg) aumentan su actividad citotóxica.
Un dato muy prometedor es que en determinados estudios se ha observado como los linfocitos T aislados de ratones alimentados con una dieta cetogénica mostraban menor cantidad de receptores PD-1 y CTLA-4 en su superficie [21].
Estos receptores son los responsables de inactivar a los linfocitos cuando su acción ya no es necesaria. Las células tumorales han desarrollado los mecanismos que contactan con estos receptores inactivando a los linfocitos. De esta forma eluden la acción del sistema inmunitario.
Estos datos nos indican que la dieta cetogénica podría dar buenos resultados como complemento a las llamadas inmunoterapias.
Alteración de la expresión genética
Anteriormente ya hemos mencionado que los cuerpos cetónicos son capaces de estimular la síntesis de determinadas proteínas clave para la activación de mecanismos de proliferación celular, inhibición de la muerte celular programada (apoptosis), etc. Esta estimulación se lleva a cabo a través de procesos epigenéticos, es decir, modificando la interpretación que la célula haría de la información contenida en el ADN.
Las células tumorales poseen proteínas (histonas) que se encargan de hacer modificaciones de este tipo para realizar acciones que les beneficien en su supervivencia (aumento de oncogenes y disminución de genes supresores de tumores). Se ha visto que los cuerpos cetónicos podrían inhibir a estas histonas revirtiendo por tanto estos procesos [22].
Inhibición de la angiogénesis
Como ya vimos en artículos anteriores, la angiogénesis, generación de nuevos vasos sanguíneos, es uno de los mecanismos más importantes que van a permitir la supervivencia y el desarrollo tumoral. Gracias a ella, el suministro de recursos a la masa tumoral es constante.
En ensayos con ratones se ha estudiado el efecto de la dieta cetogénica, tanto sola como en combinación con quimioterapia, sobre la angiogénesis para cáncer cerebral, de hígado, gástrico y neuroblastoma [23]. A pesar de que estos estudios sugieren el efecto antiangigénico de la dieta cetogénica, los mecanismos subyacentes aún son desconocidos.
Dieta cetogénica en combinación con las terapias actuales
De manera importante, parece que la dieta cetogénica presenta enormes beneficios como adyuvante de las terapias actuales. Esto quiere decir que en combinación con estas terapias podrían obtenerse efectos anticancerígenos mucho más potentes.
Estudios en ratones muestran como el 82% de los individuos usados en los ensayos, muestran una remisión completa tumoral al tratarlos con una combinación de radioterapia y dieta cetogénica, incluso cuando los ratones vuelven a una dieta normal. Usando el mismo modelo también se ha demostrado en el caso de la quimioterapia [24].
A diferencia de los tratamientos actuales, no se han descrito efectos secundarios de importancia en aquellos pacientes con cáncer sometidos a tratamientos con dieta cetogénica. Solamente se han descrito algunos casos de tumores con características genéticas concretas en los que se ha observado un crecimiento tumoral cuando el paciente era sometido a dieta cetogénica [24].

Conclusiones
El metabolismo energético de las células tumorales es totalmente distinto al de las células normales, el llamado fenotipo metabólico tumoral. Este fenotipo metabólico puede usarse como diana a la que dirigir nuestra estrategia terapéutica para eliminar al tumor.
Se ha demostrado que para atacar a la célula tumoral desde el punto de vista metabólico, la inhibición de la glucolisis y la desestabilización del balance REDOX son puntos cruciales. Con la dieta cetogénica se priva a la célula tumoral de glucosa y se hace sensible a sustancias oxidantes, como la radio y la quimioterapia.
La mayoría de las células tumorales tienen mitocondrias disfuncionales, por lo tanto, son incapaces de llevar a cabo la cetolisis y la oxidación de los ácidos grasos. Esto, junto con la no disponibilidad de glucosa (provocada por la dieta cetogénica) dará lugar a la incapacidad de las células tumorales para producir la energía necesaria para sobrevivir.
Aún se necesitan muchos estudios preclínicos y clínicos para poder comparar y avalar los resultados obtenidos. Por tanto necesitamos seguir investigando sobre ello. Lo que está claro es que la dieta cetogénica es mucho más que una simple dieta nutricional usada para perder peso. Podría convertirse en una potente estrategia como tratamiento antitumoral en combinación con la terapia actual.
Bibliografía
- Thomas M. Ashton1,W. Gillies McKenna1, Leoni A. Kunz-Schughart1,2,3, and Geoff S. Higgins1. Oxidative Phosphorylation as an Emerging Target in Cancer Therapy. Clin Cancer Res; 24(11) June 1, 2018
- Maja Grabacka 1,*, Malgorzata Pierzchalska 1 , Matthew Dean 2 and Krzysztof Reiss 2. Regulation of Ketone Body Metabolism and the Role of PPARα (2016)
- Raaella Longo, Carolina Peri, Dalma Cricrì, Lara Coppi, Donatella Caruso, Nico Mitro, Emma De Fabiani and Maurizio Crestani. Ketogenic Diet: A New Light Shining on Old but Gold Biochemistry. Nutrients 2019, 11, 2497
- W.Wheless,Historyandoriginoftheketogenicdiet,in:C.E.Stafstrom,J.M. Rho(Eds.),EpilepsyandtheKetogenicDiet,HumanaPress,Totowa,NJ, 2004,pp.31–50.
- Freeman JM, Kossoff EH. Ketosis and the ketogenic diet, 2010: advances in treating epilepsy and other disorders. Adv Pediatr. 2010; 57:315–329.
- Stafstrom CE, Rho JM. The ketogenic diet as a treatment paradigm for diverse neurological disorders. Front Pharmacol. 2012; 3:59.
- L Gupta, D Khandelwal, S Kalra, P Gupta, D Dutta, and S Aggarwal. Ketogenic diet in endocrine disorders: Current perspectives. J Postgrad Med. 2017 Oct-Dec; 63(4): 242–251.
- Robert Stone Dow Neurobiology Laboratories, Legacy Research Institute, Portland, Oregon, New insights into the mechanisms of the ketogenic diet. Curr Opin Neurol. 2017 April ; 30(2): 187–192.
- A Paoli1, A Rubini1, JS Volek2 and KA Grimaldi3. Beyond weight loss: a review of the therapeutic uses of very-low-carbohydrate (ketogenic) diets. European Journal of Clinical Nutrition (2013) 67, 789–796
- Angela Poffa, Andrew P. Koutnika, Kathleen M. Eganb, Solmaz Sahebjamc, Dominic D’Agostinoa, Nagi B. Kumarb. Targeting the Warburg effect for cancer treatment: Ketogenic diets for management of glioma. Seminars in Cancer Biology 56 (2019) 135–148
- Allen n,1, SudershanK.Bhatia 1, CarrynM.Anderson, Julie M.Eichenberger-Gilmore,ZitaA.Sibenaller,KrantiA.Mapuskar, Joshua D.Schoenfeld,JohnM.Buatti,DouglasR.Spitz,MelissaA.Fath. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism, RedoxBiology2(2014)963–970
- Hay, N., 2016. Reprogramming glucose metabolism in cancer: can it be exploited for cancer therapy? Nature Reviews Cancer 16:635e649.
- J. Fine, A. Miller, E.V. Quadros, J.M. Sequeira, R.D. Feinman, Acetoacetate reduces growth and ATP concentration in cancer cell lines which over-express uncoupling protein 2, Cancer Cell Int. 9 (2009).
- S. Volek, M.J. Sharman, Cardiovascular and hormonal aspects of very-low-carbohydrate ketogenic diets, Obes. Res. 12 (Suppl. 2) (2004) 115S–123S
- Shimazu, M.D. Hirschey, J. Newman, W. He, K. Shirakawa, N. Le Moan, et al., Suppression of oxidative stress by beta-hydroxybutyrate, an endogenous histone deacetylase inhibitor, Science 339 (2013) 211–214,
- Kashiwaya, K. Sato, N. Tsuchiya, S. Thomas, D.A. Fell, R.L. Veech, et al., Control of glucose utilization in working perfused rat heart, J. Biol. Chem. 269 (1994) 25502–25514.
- G. Allen, S.K. Bhatia, J.M. Buatti, K.E. Brandt, K.E. Lindholm, A.M. Button, et al., Ketogenic diets enhance oxidative stress and radio-chemo-therapy esponses in lung cancer xenografts, Clin. Cancer Res. 19 (2013) 3905–3913
- M. Poff, C. Ari, P. Arnold, T.N. Seyfried, D.P. D’Agostino, Ketone supplementation decreases tumor cell viability and prolongs survival of mice with metastatic cancer, Int. J. Cancer 135 (2014) 1711–1720
- Poff A., Ward N., D’Agostino D., Metabolic effects of exogenous ketone supplementation − an alternative or adjuvant to the ketogenic diet as a cancer therapy? Keystone Symposia − New Frontiers in tumor Metabolism. Banff, Alberta, Canada, 2016.
- H. Youm, K.Y. Nguyen, R.W. Grant, E.L. Goldberg, M. Bodogai, D. Kim, et al., The ketone metabolite beta-hydroxybutyrate blocks NLRP3 inflammasome-mediated inflammatory disease, Nat. Med. 21 (2015) 263–269.
- M. Lussier, E.C. Woolf, J.L. Johnson, K.S. Brooks, J.N. Blattman, A.C. Scheck, Enhanced immunity in a mouse model of malignant glioma is mediated by a therapeutic ketogenic diet, BMC Cancer 16 (2016) 310.
- Ceccacci, S. Minucci, Inhibition of histone deacetylases in cancer therapy: lessons from leukaemia, Br. J. Cancer 114 (2016) 605–611
- Woolf, E.C., Curley, K.L., Liu, Q., Turner, G.H., Charlton, J.A., Preul, M.C., et al., 2015. The ketogenic diet alters the hypoxic response and affects expression of proteins associated with angiogenesis, invasive potential and vascular permeability in a mouse glioma model. PLoS One 10:e0130357.
- C. Scheck, M. Abdelwahab, P. Stafford, D.-Y. Kim, S. Iwai, M.C. Preul, et al., Mechanistic studies of the ketogenic diet as an adjuvant therapy for malignant gliomas, American Association for Cancer Research 101 st Annual Meeting, Washington, D.C.: AACR, 2010 p. 638.
- Daniela D Weber, Sepideh Aminazdeh‐Gohari, Barbara Kofler. Ketogenic diet in cancer therapy. AG IING 2018, Vol. 10, No. 2


Todavía no hay comentarios